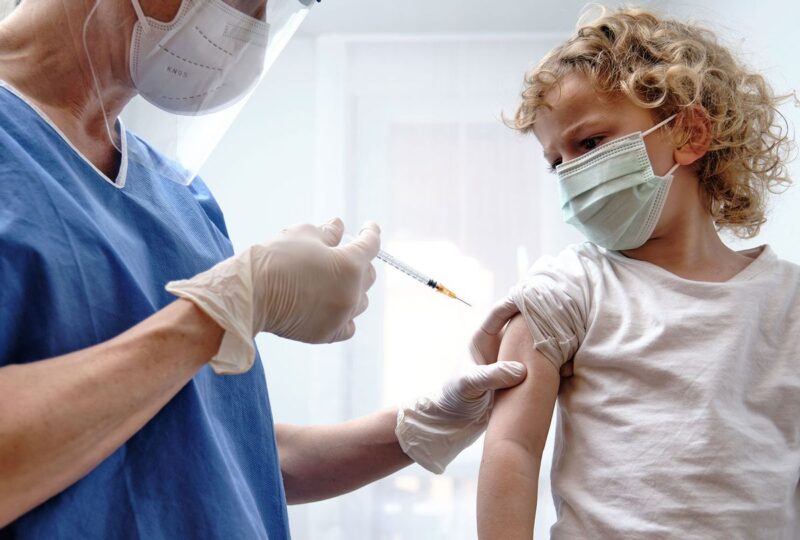
Le nombre de groupes pouvant recevoir le vaccin COVID-19 n’a cessé de croître depuis le lancement du premier vaccin pour adultes – d’abord les adolescents, puis les enfants de 5 à 11 ans. Pourtant, les enfants de moins de cinq ans, pour lesquels il n’existe pas de vaccin autorisé, constituent un groupe qui a toujours été exclu.
De nombreux parents vaccinés sont donc anxieux à l’idée d’avoir de jeunes enfants non vaccinés dans leur foyer. Et au fur et à mesure que des versions du vaccin Pfizer étaient autorisées par la Food and Drug Administration – d’abord pour les adolescents, puis pour les enfants de 5 à 11 ans – les enfants de moins de 5 ans semblaient prêts à être les prochains à recevoir le feu vert pour une vaccination.
Mais presque un an après l’autorisation du vaccin pour les adolescents et les préadolescents, il n’y a toujours pas de vaccin à l’horizon pour les plus petits. Maintenant, les parents d’enfants de moins de cinq ans sont confrontés à la réalité qu’ils devront attendre encore plus longtemps pour faire vacciner leurs enfants contre le COVID-19.
Le retard de l’autorisation de la FDA pour un vaccin destiné aux jeunes enfants a été rapporté pour la première fois par Politico jeudi dernier, via trois sources ayant connaissance du dossier. La cause ? Selon le rapport, les responsables de la santé pensent qu’il serait plus facile d’autoriser et de promouvoir deux vaccins auprès des parents, plutôt que d’en autoriser un maintenant, puis un second plus tard – en particulier si le second offre une meilleure protection, ce qui pourrait entraîner une plus grande confusion et une plus grande anxiété.
La semaine dernière, Moderna a annoncé son intention de demander une autorisation d’utilisation d’urgence pour son vaccin d’ici la fin du mois. Cependant, la FDA ne dispose toujours pas de données actualisées sur le vaccin proposé par Pfizer/BioNTech pour les enfants.
Plus tard dans la journée, Kasie Hunt, de CNN, a interviewé l’expert en maladies infectieuses Anthony Fauci, qui a confirmé que l’organisme de réglementation… envisage d’attendre jusqu’à juin. Hunt a demandé : “Si Moderna est prêt à faire une demande pour ce [Emergency Use Authorization]…[Emergency Use Authorization]et que nous pouvons avoir [the vaccine] en mai, pourquoi ne pouvons-nous pas l’avoir en mai ?” Fauci a dit qu’il n’avait pas “de réponse à cette question”.
Pourtant, aucune annonce officielle n’a été faite par les CDC ou la Food and Drug Administration (FDA) en date du 26 avril. De nombreux parents ont donc l’impression d’être dans l’ignorance.
La semaine dernière, le gouverneur du Colorado, Jared Polis, a appelé à “plus d’urgence et d’action” sur la question.
“Il est immoral d’attendre plus longtemps”, a-t-il écrit dans une lettre envoyée à Biden. “De nombreux parents de jeunes enfants se sentent laissés pour compte, et sont à juste titre mécontents que le manque d’action et d’urgence de la FDA les empêche de protéger leurs enfants et leurs proches comme tout le monde.”
Cette nouvelle intervient également dans un contexte d’inquiétude croissante pour les enfants non vaccinés, alors que les mesures d’atténuation de la santé publique sont assouplies dans tout le pays. La semaine dernière, les Centres de contrôle et de prévention des maladies (CDC) ont publié un rapport indiquant que les nourrissons et les enfants âgés de 0 à 4 ans ont été hospitalisés environ cinq fois plus souvent pendant la vague omicron que pendant la vague delta. Les enfants non vaccinés âgés de 5 à 11 ans ont également été à l’origine d’un nombre record d’hospitalisations pédiatriques pendant la vague omicron. Cette semaine, la FDA a donné sa première approbation complète pour le remdesivir, traitement du COVID-19, pour les enfants de moins de 12 ans, mais a souligné qu’il ne remplaçait pas la vaccination.
À la fin de l’année 2021, les responsables de la santé au sein de l’administration espéraient autoriser les vaccins de Pfizer et BioNTech pour les enfants âgés de six mois à cinq ans au début de l’année 2022, peut-être en février 2022. Mais à l’approche de février 2022, la possibilité d’une autorisation a été repoussée au printemps ; la Food and Drug Administration (FDA) a alors déclaré que l’agence souhaitait recevoir davantage de données sur la possibilité d’un vaccin à trois doses, en raison des craintes que l’omicron n’affecte l’efficacité du vaccin. Bien que la FDA n’ait pas précisé de calendrier à l’époque, STAT News a rapporté que les données sur le vaccin ne seraient pas disponibles avant avril, ce qui a fait naître l’espoir que le printemps apporterait enfin une autorisation d’utilisation d’urgence (EUA). Et maintenant, les parents envisagent la possibilité d’une approbation en juin, car les données d’efficacité de Pfizer et BioNTech ne sont toujours pas disponibles.
Blumberg a noté que même une protection de 40 ou 50 % est “bonne”. “C’est similaire au vaccin contre la grippe”, a déclaré Blumberg.
Dean Blumberg, chef des maladies infectieuses pédiatriques et professeur associé au département de pédiatrie de l’Université de Californie, à Davis, a souligné à Salon que le retard continue d’être lié à l’obtention du bon dosage, et d’un vaccin efficace, et non à la sécurité du vaccin pour les enfants.
“La barre est placée très haut pour la question de la sécurité, [but] il est difficile de faire l’efficacitéIl a ajouté : “Ils essaient donc de comparer les anticorps et cela a été un défi. “Ils essaient donc de faire des comparaisons d’anticorps, et cela a été un défi. Nous savons que les vaccins ne protègent pas aussi bien contre l’omicron, c’est donc une sorte de cible mouvante en termes d’efficacité que vous visez.”
En effet, les résultats que Moderna a publiés fin mars ont révélé que le vaccin à deux doses de la société était sûr pour les enfants âgés de six mois à six ans. Cependant, l’efficacité contre une infection par la variante omicron était faible : entre 37,5 % et 44 %. Auparavant, Pfizer et BioNTech avaient annoncé que pour les enfants âgés de deux à cinq ans, leur vaccin à deux doses ne produisait pas des niveaux d’anticorps similaires à ceux observés chez les adultes. Par conséquent, les sociétés poursuivent l’essai avec une troisième dose.
Blumberg a déclaré à Salon que la logistique d’une troisième dose pourrait également poser des problèmes.
“Plus de doses signifient plus d’occasions potentielles manquées d’être complètement à jour avec la vaccination”, a déclaré Blumberg. “Et bien sûr, personne n’aime que les enfants se fassent [more] vaccins.”
M. Blumberg a ajouté qu’il était optimiste et que, même si l’efficacité du vaccin était plus faible que prévu, il offrirait tout de même une certaine protection, ce qui est mieux que rien.
Blumberg a noté que même une protection de 40 ou 50 % est “bonne”. “C’est similaire au vaccin contre la grippe”, a déclaré Blumberg. “Prévenir l’infection empêchera la possibilité d’un long COVID à terme, donc il y a certainement des avantages pour l’enfant individuel, et puis il y a aussi des avantages pour les familles – de sorte que si les enfants sont infectés, alors vous êtes moins susceptibles d’avoir une transmission au sein des familles.”
Bien que les parents soient certainement frustrés, certains sont prêts à attendre un peu plus longtemps.
Crystal King, fondatrice d’Amazing Baby et mère de deux enfants en bas âge, a déclaré que si elle devait modifier ses projets de voyage pour quelques mois de plus afin d’assurer la sécurité de ses enfants, elle le ferait “volontiers”.
“J’ai signé pour être un parent pendant toute une vie, et honnêtement, la maternité m’a appris à être plus patiente”, a déclaré King à Salon.