Des grenouilles traitées brièvement avec un cocktail de cinq médicaments administrés par un bioréacteur portable sur le moignon ont pu faire repousser un membre fonctionnel et presque complet.
Pour des millions de patients qui ont perdu un membre pour des raisons allant du diabète au traumatisme, la possibilité de retrouver une fonction par régénération naturelle reste hors de portée. La régénération des jambes et des bras reste l’apanage des salamandres et des super-héros.
Mais dans une étude publiée dans le journal Science Advances, des scientifiques de l’Université de Tufts et de l’Institut Wyss de l’Université de Harvard nous ont rapprochés de l’objectif de la médecine régénérative.
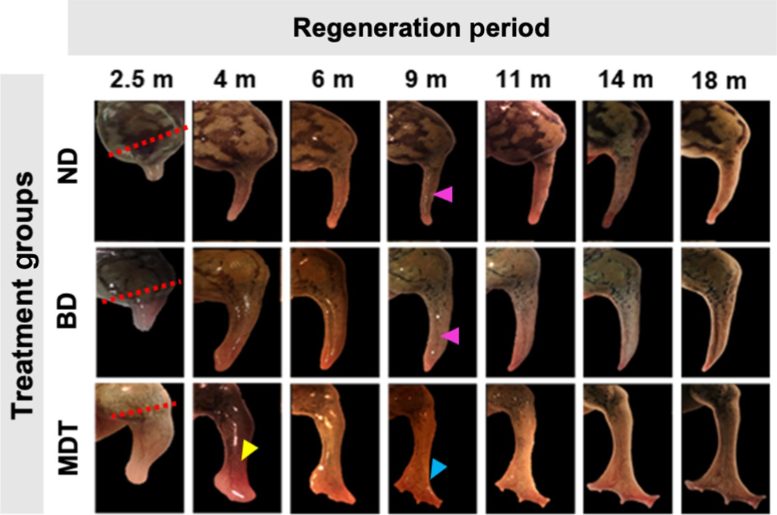
Sur des grenouilles adultes, qui sont naturellement incapables de régénérer leurs membres, les chercheurs ont pu déclencher la repousse d’une patte perdue à l’aide d’un cocktail de cinq médicaments appliqué dans un dôme bioréacteur portable en silicone qui scelle l’élixir sur le moignon pendant 24 heures seulement. Ce bref traitement déclenche une période de repousse de 18 mois qui permet de restaurer une jambe fonctionnelle.
De nombreuses créatures ont la capacité de régénérer entièrement au moins certains membres, notamment les salamandres, les étoiles de mer, les crabes et les lézards. Les vers plats peuvent même être découpés en morceaux, chaque morceau reconstituant un organisme entier. Les humains sont capables de refermer des plaies par la croissance de nouveaux tissus, et nos foies ont une capacité remarquable, presque semblable à celle des vers plats, de se régénérer à pleine capacité après une perte de 50 %.
Mais la perte d’un membre important et structurellement complexe – un bras ou une jambe – ne peut être restaurée par aucun processus naturel de régénération chez l’homme ou les mammifères. En fait, nous avons tendance à recouvrir les blessures majeures d’une masse amorphe de tissu cicatriciel, la protégeant de toute nouvelle perte de sang et infection et empêchant toute nouvelle croissance.

Grenouille à griffes africaine normale. Crédit : Pouzin Olivier
Coup de pouce à la régénération
Les chercheurs de Tufts ont déclenché le processus de régénération chez les grenouilles africaines en enfermant la plaie dans un bouchon de silicone, qu’ils appellent un BioDome, contenant un gel de protéines de soie chargé du cocktail de cinq médicaments.
Chaque médicament a rempli un objectif différent, notamment en atténuant l’inflammation, en inhibant la production de collagène qui conduirait à la cicatrisation et en encourageant la croissance de nouvelles fibres nerveuses, de vaisseaux sanguins et de muscles. La combinaison et le bioréacteur ont fourni un environnement local et des signaux qui ont fait pencher la balance loin de la tendance naturelle à fermer le moignon et vers le processus de régénération.
Les chercheurs ont observé une croissance spectaculaire des tissus chez de nombreuses grenouilles traitées, recréant une jambe presque entièrement fonctionnelle. Les nouveaux membres avaient une structure osseuse étendue avec des caractéristiques similaires à la structure osseuse d’un membre naturel, un complément plus riche de tissus internes (y compris des neurones), et plusieurs “orteils” ont poussé à partir de l’extrémité du membre, bien que sans le soutien de l’os sous-jacent.
Le membre repoussé bougeait et répondait à des stimuli tels que le toucher d’une fibre rigide, et les grenouilles étaient capables de l’utiliser pour nager dans l’eau, se déplaçant comme une grenouille normale.
Les tissus mous des animaux PCT étaient systématiquement plus longs que ceux des animaux BD ou ND à partir de 8 mpa. [F(2,19) = 61.9, P < 0.05]. Crédit : Murugan, et. al., Science Advances 2022, DOI : 10.1126/sciadv.abj2164
“Il est passionnant de voir que les médicaments que nous avons sélectionnés contribuaient à créer un membre presque complet”, a déclaré Nirosha Murugan, chercheur affilié au Allen Discovery Center de Tufts et premier auteur de l’article. “Le fait qu’il n’ait fallu qu’une brève exposition aux médicaments pour déclencher un processus de régénération de plusieurs mois suggère que les grenouilles et peut-être d’autres animaux pourraient avoir des capacités de régénération dormantes qui peuvent être déclenchées.”
Les chercheurs ont exploré les mécanismes par lesquels cette brève intervention pouvait entraîner une croissance à long terme. Dans les premiers jours suivant le traitement, ils ont détecté l’activation de voies moléculaires connues qui sont normalement utilisées dans un embryon en développement pour aider le corps à prendre forme.
L’activation de ces voies pourrait permettre que la charge de la croissance et de l’organisation des tissus soit prise en charge par le membre lui-même, comme cela se produit chez l’embryon, plutôt que de nécessiter une intervention thérapeutique continue pendant les nombreux mois nécessaires à la croissance du membre.
Comment fonctionne le BioDome
Les animaux naturellement capables de se régénérer vivent principalement dans un environnement aquatique. La première étape de la croissance après la perte d’un membre est la formation d’une masse de cellules souches à l’extrémité du moignon, appelée blastème, qui est utilisée pour reconstruire progressivement la partie perdue du corps. La plaie est rapidement recouverte parles cellules de la peau dans les 24 heures qui suivent la blessure, protégeant ainsi les tissus en cours de reconstruction.
“Les mammifères et autres animaux en régénération ont généralement leurs blessures exposées à l’air ou en contact avec le sol, et il leur faut des jours ou des semaines pour se refermer avec du tissu cicatriciel”, a déclaré David Kaplan, professeur d’ingénierie de la famille Stern à Tufts et co-auteur de l’étude. “L’utilisation de la coiffe BioDome dans les 24 premières heures permet d’imiter un environnement de type amniotique qui, associé aux bons médicaments, permet au processus de reconstruction de se dérouler sans l’interférence du tissu cicatriciel.”
Prochaines étapes chez les grenouilles et les mammifères
Les travaux précédents de l’équipe de Tufts ont montré un degré significatif de croissance du membre déclenché par un seul médicament, la progestérone, avec le BioDome. Cependant, le membre résultant s’est développé comme une pointe et était loin du membre fonctionnel de forme plus normale obtenu dans l’étude actuelle.
Le cocktail de cinq médicaments représente une étape importante vers la restauration de membres de grenouille entièrement fonctionnels et suggère qu’une exploration plus poussée des combinaisons de médicaments et de facteurs de croissance pourrait conduire à la régénération de membres encore plus complets sur le plan fonctionnel, avec des doigts normaux, des sangles et des caractéristiques squelettiques et musculaires plus détaillées.
“Nous testerons ensuite comment ce traitement pourrait s’appliquer aux mammifères”, a déclaré l’auteur correspondant Michael Levin, professeur de biologie Vannevar Bush à l’école des arts et des sciences, directeur du Allen Discovery Center à Tufts et membre associé du corps enseignant de l’Institut Wyss.
“Recouvrir la plaie ouverte d’un environnement liquide sous le BioDome, avec le bon cocktail de médicaments, pourrait fournir les premiers signaux nécessaires pour mettre en marche le processus de régénération”, a-t-il déclaré. “Il s’agit d’une stratégie axée sur le déclenchement de programmes dormants et inhérents de modelage anatomique, et non sur la microgestion d’une croissance complexe, puisque les animaux adultes disposent encore des informations nécessaires à la fabrication de leurs structures corporelles.”
Référence : “Acute multidrug delivery via a wearable bioreactor facilitates long-term limb regeneration and functional recovery in adult Xenopus laevis” par Nirosha J. Murugan, Hannah J. Vigran, Kelsie A. Miller, Annie Golding, Quang L. Pham, Megan M. Sperry, Cody Rasmussen-Ivey, Anna W. Kane, David L. Kaplan, David L. Kaplan et le Dr. Kane, David L. Kaplan et Michael Levin, 26 janvier 2022, Science Advances.
DOI : 10.1126/sciadv.abj2164




